MEZCLAS, COMPUESTOS Y ELEMENTOS
LA CLASIFICACIÓN DE LAS SUSTANCIAS.
Clasificación de sustancias químicas
según la ONU
Clase
1. EXPLOSIVOS
Son
sustancias sólidas o líquidas, o mezclas de ellas, que por sí mismas son
capaces de reaccionar químicamente produciendo gases a tales temperaturas,
presiones y velocidades que pueden ocasionar daños graves en los alrededores.
Se consideran 6 subclases de acuerdo con la forma como una sustancia puede
explotar.
Subclase 1.1: corresponde a sustancias o artículos que ofrecen
peligro de explosión en masa. Es decir, que afecta toda la carga en forma
instantánea.
Subclase 1.2: Sustancias o artículos que ofrecen peligro de
proyección mas no explosión en masa.
Subclase 1.3: sustancias o artículos que ofrecen peligro de fuego
y en menor grado proyección de partículas, o ambos, mas no peligro de explosión
en masa.
Subclase 1.4: Sustancias o artículos que no representan peligro
significativo. Pueden entrar en ignición eventualmente.
Subclase 1.5: Sustancias o artículos muy insensibles que ofrecen
en condiciones especiales, peligro de explosión en masa.
Subclase 1.6: Sustancias o artículos extremadamente insensibles
que no tienen peligro de explosión en masa.
Ejemplos de sustancias o
artículos explosivos son: La Dinamita, el TNT, Pólvora negra, Nitroglicerina,
Nitrato de pentaeritritol.
Clase 2.
GASES. Son
sustancias que se encuentran totalmente en estado gaseoso a 20ºC y una presión
estándar de 101.3 Kpa. Existen gases:
COMPRIMIDOS, que se encuentran totalmente en estado gaseoso al
ser empacados o envasados para el transporte, a 20ºC. Ej. Aire comprimido
LICUADOS, que se encuentran parcialmente en estado líquido al
ser empacados o envasados para el transporte a 20ºC. Ej. GLP
Gas Inflamable
CRIOGÉNICOS, que se encuentran parcialmente en estado líquido al
ser empacados o envasados para el transporte a muy bajas temperaturas. Ej.
Nitrógeno criogénico
|
EN SOLUCIÓN, que se encuentran totalmente disueltos en un
líquido al ser empacados o envasados para el transporte. Ej. Acetileno (en
acetona)
Con respecto al tipo de riesgo
que ofrecen, los gases se clasifican en dos subdivisiones:
Gas no inflamable
Subclase
2.1: Gases
Inflamables, pueden incendiarse fácilmente en el aire cuando se mezclan en
proporciones inferiores o iguales al 13% en volumen. Ej. Gas Propano,
Aerosoles.
|
Subclase 2.2: Gases No-inflamables, no tóxicos; Pueden ser
asfixiantes simples u oxidantes. Ej. Nitrógeno.
Subclase 2.3: Gases Tóxicos; ocasionan peligros para la salud,
son tóxicos o corrosivos. Ej. Cloro.
Clase 3. LÍQUIDOS INFLAMABLES
Clase 3.
Líquidos Inflamables. Son líquidos
o mezclas de ellos, que pueden contener sólidos en suspensión o solución, y que
liberan vapores inflamables por debajo de 35ºC (punto de inflamación). Por lo
general son sustancias que se transportan a temperaturas superiores a su punto
de inflamación, o que siendo explosivas se estabilizan diluyéndolas o
suspendiéndolas en agua o en otro líquido. Ej. Gasolina, benceno y
nitroglicerina en alcohol.
Clase 4. SÓLIDOS CON PELIGRO DE INCENDIO
Clase 4. Sólidos con peligro de incendio. Constituyen cuatro
subdivisiones:
Subclase
4.1: Sólidos Inflamables. Son aquellos que bajo condiciones de transporte son combustibles o
pueden contribuir al fuego por fricción. Ej. Fósforo.
Subclase
4.2: Sólidos espontáneamente combustibles. Son aquellos que se calientan espontáneamente al
contacto con el aire bajo condiciones normales. Ej. Hidrosulfito de sodio.
Subclase
4.3: Sólidos que emiten gases inflamables al contacto con el agua. Son aquellos que reaccionan violentamente con el
agua o que emiten gases que se pueden inflamar en cantidades peligrosas cuando
entran en contacto con ella. Ej. Metales alcalinos como sodio, potasio.
Clase 5- OXIDANTES Y PERÓXIDOS ORGÁNICOS.
Subclase
5.1: Sustancias oxidantes. generalmente
contienen
oxígeno y causan la combustión o contribuyen a ella. Ej. Agua oxigenada
(peróxido de hidrógeno); Nitrato de potasio.
Subclase
5.2: Peróxidos orgánicos.Sustancias
de naturaleza orgánica que contienen estructuras bivalentes -O-O-, que
generalmente son inestables y pueden favorecer una descomposición explosiva,
quemarse rápidamente, ser sensibles al impacto o la fricción o ser altamente
reactivas con otras sustancias. Ej. Peróxido de benzoílo, Metiletilcetona
peróxido.
Clase 6. SUSTANCIAS
TÓXICAS E INFECCIOSAS
El término tóxico puede
relacionarse con "venenoso" y la clasificación para estas sustancias
está dada de acuerdo con la DL50 oral, inhalatoria y dérmica. Existen dos
subdivisiones:
Subclase
6.1: Sustancias Tóxicas. Son líquidos o sólidos que pueden ocasionar daños graves a la salud o la
muerte al ser ingeridos, in halados o entrar en contacto con la piel. Ej.
Cianuros, Sales de metales pesados.
Subclase
6.2: Materiales infecciosos. Son aquellos
microorganismos
que se reconocen como patógenos (bacterias, hongos, parásitos, virus e incluso
híbridos o mutantes) que pueden ocasionar una enfermedad por infección a los
animales o a las personas. Ej. Ántrax, VIH, E. Coli.
Clase 7. MATERIALES RADIOACTIVOS.
Son
materiales que contienen radionúclidos y su peligrosidad depende de la cantidad
de radiación que genere así como la clase de descomposición atómica que sufra.
La contaminación por radioactividad empieza a ser considerada a partir de 0.4
Bq/cm2 para emisores beta y gama, o 0.04 Bq/cm2 para emisores alfa. Ej. Uranio,
Torio 232, Yodo 125, Carbono 14.
Clase 8. SUSTANCIAS
CORROSIVAS
Corresponde
a cualquier sustancia que por reacción química, puede causar daño severo o
destrucción a toda superficie con la que entre en contacto incluyendo la piel,
los tejidos, metales, textiles, etc. Causa entonces quemaduras graves y se
aplica tanto a líqudos o sólidos que tocan las superficies como a gases y
vapores que en cantidad suficiente provocan fuertes irritaciones de las
mucosas. Ej. Ácidos y cáusticos.
Clase 9. SUSTANCIAS Y
ARTÍCULOS PELIGROSOS MISCELÁNEOS
Son
materiales que no se encuentran incluidos en las clases anteriormente
mencionadas y por tanto pueden ser transportados en condiciones que deben ser
estudiadas de manera particular. Ej. Asbesto, fibra de vidrio, sílice. Dentro
de este grupo se han incluido las sustancias que ocasionan de manera especial,
contaminación ambiental por bioacumulación o por toxicidad a la vida acuática
(polutantes marinos) o terrestre (contaminante ambiental). Ej.
1,2-Dibromoetano.
MEZCLA
Se conoce como la combinación de dos o más sustancias, sin que se produzca como consecuencia de esta una reacción química y las sustancias participantes de la mencionada mezcla conservarán sus propiedades e identidad.
Un ejemplo común de mezcla es la de la arena con las limaduras de hierro, la cual, a simple vista, es fácil de comprobar que ambas siguen manteniendo sus propiedades.
EXISTEN DOS TIPOS DE MEZCLAS, LAS MEZCLAS HOMOGÉNEAS Y LAS MEZCLAS HETEROGÉNEAS.
MEZCLA HOMOGÉNEAS
Son aquellas que se producen cuando se unen dos o más sustancias puras en proporción variable, las cuales, mantendrán tal cual sus propiedades originales y podrán ser separadas a través de procedimientos físicos o mecánicos.
En las homogéneas uno no puede ver a simple vista sus componentes, ni siquiera echando mano de un microscopio electrónico se podrán distinguir las partes, ya que en cualesquiera de sus partes la mezcla presentará la misma composición. Se las conocerá como disoluciones, una vez producida la mezcla, encontrándose el soluto en una proporción menor que el disolvente.
Entre las homogéneas se reconocen cinco mezclas básicas: sólido-sólido, líquido-sólido, líquido-líquido, gas-líquido y gas-gas.
Son aquellas que ostentan una composición no uniforme, es decir, están conformadas por dos o más fases físicamente diferentes y dispuestas de manera absolutamente desigual. En lo que sí coinciden con las anteriores es que cada una de las partes de una composición heterogénea podrá ser separada unas de otras a través de procedimientos mecánicos. La madera, el granito, el aceite y el agua, entre otras, son ejemplos de mezclas heterogéneas.
COMPUESTO:
Es una sustancia formada por la unión
de dos o más elementos de la tabla periódica, en una razón fija. Una
característica esencial es que tiene una fórmula química. Por ejemplo, el agua
es un compuesto formado por hidrógeno y oxígeno en la razón de 2 a 1 (en número
de átomos).
ELEMENTO:
Es una sustancia formada por átomos
con el mismo número de protones en el núcleo. Este número se conoce como el
número atómico del elemento. Por ejemplo, todos los átomos con 6 protones en
sus núcleos son átomos del elemento químico carbono, mientras que todos los
átomos con 92 protones en sus núcleos son átomos del elemento uranio.
La materia forma todo lo que nos rodea, y ya vimos que en la Tierra podemos encontrarla en tres estados Físicos: Sólido, Líquido, Gaseoso y Plasma. En general, las sustancias que encontramos en la naturaleza y que usan las personas, se encuentran en forma de mezclas, como ocurre, por ejemplo, en los minerales y en el agua de mar. A través de algunos métodos y técnicas, los seres humanos hemos aprendido a separar las distintas partes de las mezclas y obtener sustancias puras: compuestos como el agua o elementos como el oxígeno.
Estado Sólido:
Podemos ver que
los átomos se hallan dispuestos en un volumen pequeño, se sitúan adyacentes,
uno al lado del otro, aunque no en contacto, formando generalmente una
estructura.
Estado Líquido:
Los átomos se
encuentran esparcidos en un volumen mayor, sin seguir ninguna estructura. La
separación entre cada átomo es mayor que en el sólido.
Estado Gaseoso:
Los átomos ocupan
un volumen mucho mayor. Es el estado en que los átomos están más separados.
Estado de Plasma:
Sus componentes
no son átomos, sino partículas individuales y núcleos de átomos. Parece un gas,
pero formado por iones (cationes -núcleos y protones con carga positiva-,
neutrones sin carga y electrones -con carga negativa-). Cada componente del estado
de plasma está cargada eléctricamente y el conjunto ocupa un gran volumen.
CARACTERÍSTICAS DE LOS ESTADOS DE AGREGACIÓN DE LA MATERIA:
Sólido:
1.
Forma y volumen definidos
2.
Cohesión (atracción)
3.
Vibración
4.
Tienen forma definida o rígida
5.
No pueden comprimirse
6.
Resistentes a fragmentarse
7.
No fluyen
8.
Algunos de ellos se subliman (yodo)
9.
Volumen tenso
Líquido:
1.
Cohesión menor (regular)
2.
Movimiento energía cinética.
3.
No poseen forma definida.
4.
Toma la forma de la superficie o el
recipiente que lo contiene.
5.
En el frío se comprime, excepto el
agua.
6.
Posee fluidez a través de pequeños
orificios.
7.
Puede presentar difusión.
Gaseoso:
1.
Cohesión casi nula.
2.
Sin forma definida.
3.
Su volumen solo existe en recipientes
que lo contengan.
4.
Pueden comprimirse fácilmente.
5.
Ejercen presión sobre las paredes del
recipiente contenedor.
6.
Ejercen movimiento ultra dinámico.
Plasma:
1.
Gas totalmente ionizado,o sea que los
átomos del gas han perdido al menos un electrón
2.
Requiere una temperatura de unos 100
000 ºK, para que se forme el plasma.
3.
Es un buen conductor de la corriente
eléctrica y del calor por tener electrones libres.
4.
La densidad puede ser como la de un
líquido, a presiones y temperaturas elevadas.
5.
La viscosidad se asemeja a la de un
líquido a altas temperaturas y presiones.
RESPONDE LAS PREGUNTAS:
- ¿Que es el Mezcla?
- ¿Que es el Compuestos?
- ¿Que es el Elementos?
- ¿Que es la Mezcla Homogénea?
- ¿Que es la Mezcla Heterogénea?
- ¿Que es el Soluto?
- ¿Que es el Solvente?
- ¿Que son las Sustancias puras?
- ¿Que es el Disolvente?
- ¿Que es la Disolución?
- ¿Que es el Sólido?
- ¿Que es el Líquido?
- ¿Que es el Gas?
- ¿Que es el Plasma?
COMO ES LA ESTRUCTURA DE LOS MATERIALES.
La estructura es la manera en que se
agrupan los átomos en una molécula, esto trae como consecuencia propiedades
físicas, químicas y fisicoquímicas distintas entre moléculas compuestas por los
mismos átomos y en las mismas cantidades pero con agrupación distinta es decir
isómeros.
PORTADORES DEL ESTUDIO DE LA ESTRUCTURA DE LOS MATERIALES
Demócrito:
planteo que la materia no se puede dividir indifinidamente, por eso denomino el
átomo a las partículas de la sustancia que en griego significa indivisible.
Leucipo:
según el cual la realidad está formada tanto por partículas infinitas,
indivisibles, de formas variadas y siempre en movimiento, los átomos (lo que no
puede ser dividido), como por el vacío.
LEUCIPO Y DEMÓCRITO:
Para
el año 400 a. de C. Demócrito y Leucipo propusieron la primera teoría atómica
llamada la "Discontinuidad de la Materia". Esta consistió en que la
materia se podía dividir indeterminadamente en partículas cada vez más pequeñas
hasta obtener unas diminutas e indivisibles, a las que Demócrito llamó átomos,
las cuales constituyen a la materia. Así había átomos de oro, de agua, aire,
rocas, etc.
A su vez a Leucipo y Demócrito de Abdera se les atribuye la fundación del atomismo mecanicista, según el cual la realidad está formada tanto por partículas infinitas, indivisibles, de formas variadas y siempre en movimiento, los átomos (ἄτομοι, s. lo que no puede ser dividido), como por el vacío.
La
teoría atomística de Demócrito y Leucipo dice así:
- Los átomos son eternos, indivisibles, homogéneos, incomprensibles e invisibles.
- Los átomos se diferencian en su forma y tamaño.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
Esta teoría, al igual que todas las teorías filosóficas griegas, no apoya sus
postulados mediante experimentos, sino que se explica mediante razonamientos
lógicos.
La
teoría propuesta por Leucipo y Demócrito no tuvo gran aceptación entre los
filósofos griegos y romanos, así que el átomo fue olvidado ya que la teoría de
que el universo estaba compuesto por cuatro elementos (tierra, agua, fuego y
aire), resulto mucho más popular, aceptada y propagada por “eruditos”, como
Aristóteles.
- Leucipo fue fundador de la filosofia atomistica y mas tarde Democrito amplio esta misma.
- Postularon la idea de la materia formadas por pequeñas particulas.
- explicaba que la formacion del universo era gracias a la combinacion de atomos elementos o particulas infinitamente pequeñas. para ellos el alma humano era un conjunto de atomos de fuego y los sentimientos y la sencibilidad como un hecho puramente pasivo, el alma era cera y la sensacion el sello. mientras larazon era el desernimiento y el juicio sobre la verdad de las impresiones.
- siglos despues, Aristoteles planteo la teoria de los 4 elementos (Agua, Tierra, Aire y Fuego)
John Dalton.
El responsable del primer modelo de átomo con base científica.
En el fondo, con Dalton la humanidad comenzó el camino que la condujo a utilizar la
energía atómica.
El modelo atómico de Dalton fue expuesto en un libro llamado “Nuevo sistema de
filosofía química”, y en síntesis decía lo siguiente:
- La materia está formada por partículas pequeñísimas llamadas “átomos”.
- Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno son iguales.
- Por otro lado, los átomos de elementos diferentes, son diferentes; por ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
Los átomos de elementos diferentes se pueden combinar en proporciones
distintas y formar más de un compuesto. Por ejemplo, un átomo de carbono con
uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de
oxígeno con uno de carbono, forman dióxido de carbono (CO2)
Algunas de estos planeamientos perdieron vigencia con el tiempo. Hoy
sabemos que los átomos sí se
pueden dividir y que no todos los
átomos de un mismo elemento son iguales; pero es innegable que fueron muy
importantes para la ciencia.
Esa no fue, sin embargo, la única contribución de John Dalton. Hizo muchos otros aportes en el campo de la meteorología y la física, e incluso en la medicina: cuando tenía 26 años se dio cuenta de que tanto él como su hermano confundían los colores. Realizó un detallado estudio de la enfermedad visual que padecía, el primero de su tipo, y por tanto desde ese momento se llamó “daltonismo”. En 1832 fue invitado a visitar al rey Guillermo IV y, cuál no fue la sorpresa de los presentes cuando el eminente científico llegó vistiendo un llamativo traje de color rojo. Claro, él lo veía gris oscuro, porque era, además de Dalton, daltónico.
Joseph Thomson. (1856-1940) partiendo
de las informaciones que se tenían hasta ese momento presentó algunas hipótesis
en1898 y 1904, intentando justificar dos hechos:(a)La materia es eléctricamente
neutra, lo que hace pensar que, además de electrones, debe de haber partículas
con cargas positivas.(b)Los electrones pueden extraerse de los átomos, pero no
así las cargas positivas. Propuso entonces un modelo para el átomo en el
que la mayoría de la masa aparecía asociada con la carga positiva (dada la
poca masa del electrón en comparación con la de los átomos) y suponiendo
que había un cierto número de electrones distribuidos uniformemente dentro de
esa masa de carga positiva (como una especie de pastel o calabaza en la que los
electrones estuviesen incrustados como si fueran trocitos de fruta o pepitas).
Según el modelo de Thomson el
átomoconsistía en una esfera uniforme demateria cargada positivamente en la
quese hallaban incrustados los electrones deun modo parecido a como lo están
lassemillas en una sandía. Este sencillomodelo explicaba el hecho de que
lamateria fuese eléctricamente neutra.
Ernest Rutherford.
(Nelson, Nueva Zelanda, 1871-Londres,
1937) Físico y químico británico. Tras licenciarse, en 1893, en Christchurch
(Nueva Zelanda), Ernest Rutherford se trasladó a la Universidad de Cambridge
(1895) para trabajar como ayudante de JJ. Thomson. En 1898 fue nombrado
catedrático de la Universidad McGill de Montreal, en Canadá. A su regreso al
Reino Unido (1907) se incorporó a la docencia en la Universidad de Manchester,
y en 1919 sucedió al propio Thomson como director del Cavendish Laboratory de
la Universidad de Cambridge.
Por sus trabajos en el campo de la
física atómica, Ernest Rutherford está considerado como uno de los padres de
esta disciplina. Investigó también sobre la detección de las radiaciones
electromagnéticas y sobre la ionización del aire producida por los rayos X.
Estudió las emisiones radioactivas descubiertas por H. Becquerel, y logró
clasificarlas en rayos alfa, beta y gamma.
El modelo atómico de Rutherford es
un modelo atómico o teoría sobre la estructura interna del
átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para
explicar los resultados de su "experimento de la lámina de oro", realizado
en 1911.
El modelo de Rutherford fue el primer
modelo atómico que incorporó el hecho de que el átomo estaba formado por dos
partes: La corteza, que está constituida por todos los electrones que hay en el
átomo, girando a gran distancia alrededor del núcleo, y el núcleo:(es muy
pequeño; en él se encuentra toda la carga eléctrica positiva y casi toda la
masa del átomo). Este modelo suponía que el átomo, estaba formado por tres
partículas: protones y neutrones, estos se encuentran en el núcleo; y
electrones (está en la corteza). Aunque hoy se sabe que los protones y los
neutrones son partículas compuestas y que las interacciones entre ellos
requieren partículas transmisoras de las fuerzas nucleares.
Por un lado se planteó el problema de
cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan
pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la
fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
Por otro lado existía otra dificultad
proveniente de la electrodinámica clásica que predice que una partícula cargada
y acelerada, como sería el caso de los electrones orbitando alrededor del
núcleo, produciría radiación electromagnética, perdiendo energía cayendo
sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de
Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a
que en un tiempo del orden de 10 − 10s, toda la energía del átomo se
habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se
trata, por tanto de un modelo físicamente inestable, desde el punto de vista de
la física clásica.
Según Rutherford, las órbitas de los
electrones no están muy bien definidas y forman una estructura compleja
alrededor del núcleo, dándole un tamaño y forma algo indefinidas. No obstante,
los resultados de su espxperimento, permitieron calcular que el radio del átomo
era diez mil veces mayor que el núcleo mismo, lo que hace que haya un gran
espacio vacío en el interior de los átomos.
Importancia
del modelo y limitaciones
La importancia del modelo de Rutherford
residió en proponer por primera vez la existencia de un núcleo en el átomo.
Término que, paradójicamente, no aparece en sus escritos. Lo que Rutherford
consideró esencial, para explicar los resultados experimentales, fue "una
concentración de carga" en el centro del átomo, ya que sin ella, no podía
explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a
la incidente. Este fue un paso crucial en la comprensión de la materia, ya
implicaba la existencia de un núcleo atómico donde se concentraba toda la carga
positiva y más del 99,9% de la nasa. Las estimaciones del núcleo revelaban que
el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones
orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado
en el centro del átomo. Además se abrían varios problemas nuevos que llevarían
al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
Niels Bohr.
(Niels Henrick David Bohr; Copenhague,
1885 - 1962) Físico danés. Considerado como una de las figuras más
deslumbrantes de la Física contemporánea y, por sus aportaciones teóricas y sus
trabajos prácticos, como uno de los padres de la bomba atómica, fue galardonado
en 1922 con el Premio Nobel de Física, "por su investigación acerca de la
estructura de los átomos y la radiación que emana de ellos".
Cursó estudios superiores de Física en
la Universidad de Copenhague, donde obtuvo el grado de doctor en 1911. Tras
haberse revelado como una firme promesa en el campo de la Física Nuclear, pasó
a Inglaterra para ampliar sus conocimientos en el prestigioso Cavendish
Laboratory de la Universidad de Cambridge, bajo la tutela de sir Joseph John
Thomson (1856-1940), químico británico distinguido con el Premio Nobel en 1906
por sus estudios acerca del paso de la electricidad a través del interior de
los gases, que le habían permitido descubrir la partícula bautizada luego por
Stoney (1826-1911) como electrón.
En 1913, Bohr desarrolló un modelo
atómico abandonando las consideraciones de la física clásica y tomando en
cuenta la Teoría cuántica de Max Planck.
Niels Bohr no desechó totalmente
el modelo planetario de Rutherford, sino que incluyo en el restricciones
adicionales. Para empezar, consideró no aplicable el concepto de la física
clásica de que una carga acelerada emite radiación continuamente.
Según la teoría cuántica de
Planck, la absorción y emisión de energía tiene lugar en forma de fotones o
cuantos. Bohr usó esta misma idea para aplicarla al átomo; es decir, el proceso
de emisión o absorción de radiación por un atomo solo
puede realizarse en forma discontinua, mediante los fotones o cuantos que se
generen por saltos electrónicos de un estado cuantizado de energía a otro.
El modelo de Bohr está
basado en los siguientes postulados, que son válidos para átomos con un
solo electrón como el hidrógeno y permitió explicar sus espectros de
emisión y absorción.
1.
Primer Postulado: Estabilidad del Electrón
Un
electrón en un átomo se mueve en una órbita circular alrededor del núcleo bajo
la influencia de la atracción coulómbica entre el electrón y el núcleo,
obedeciendo las leyes de la mecánica clásica.
Las
únicas fuerzas que actúan sobre el electrón son las fuerzas de atracción
eléctrica (Fa) y la fuerza centrípeta (Fc), que es exactamente igual a la
fuerza centrífuga.
2.
Segundo Postulado: Orbitas o niveles permitidos
En
lugar de la infinidad de órbitas posibles en la mecánica clásica, para un
electrón solo es posible moverse en una órbita para la cual el momento
angular L es un múltiplo entero de la constante de Planck h.
3.
Tercer Postulado: Niveles Estacionarios de Energía
Un
electrón que se mueva en una de esas órbitas permitidas no irradia energía
electromagnética, aunque está siendo acelerado constantemente por las fuerzas
atractivas al núcleo. Por ello, su energía total E permanece constante.
4.
Cuarto Postulado: Emisión y Absorción de Energía
Si
un electrón que inicialmente se mueve en una órbita de energía Ei cambia
discontinuamente su movimiento de forma que pasa a otra órbita de energía Ef se
emite o absorbe energía electromagnética para compensar el cambio de la energía
total. La frecuencia ν de la radiación es igual a la cantidad (Ei – Ef)
dividida por la constante de Planck h.
Erwin Schrödinger.
(Viena, 1887-id., 1961) Físico
austriaco. Compartió el Premio Nobel de Física del año 1933 con Paul Dirac por
su contribución al desarrollo de la mecánica cuántica. Ingresó en 1906 en la
Universidad de Viena, en cuyo claustro permaneció, con breves interrupciones,
hasta 1920. Sirvió a su patria durante la Primera Guerra Mundial, y luego, en
1921, se trasladó a Zurich, donde residió los seis años siguientes.
En 1926 publicó una serie de artículos
que sentaron las bases de la moderna mecánica cuántica ondulatoria, y en los
cuales transcribió en derivadas parciales su célebre ecuación diferencial, que
relaciona la energía asociada a una partícula microscópica con la función de
onda descrita por dicha partícula. Dedujo este resultado tras adoptar la
hipótesis de De Broglie, enunciada en 1924, según la cual la materia y las
partículas microscópicas, éstas en especial, son de naturaleza dual y se
comportan a la vez como onda y como cuerpo.
En el modelo de Schrödinger se
abandona la concepción de los electrones como esferas diminutas con carga que
giran en torno al núcleo, que es una extrapolación de la experiencia a nivel
macroscópico hacia las diminutas dimensiones del átomo. En vez de esto,
Schrödinger describe a los electrones por medio de una función de onda, el
cuadrado de la cual representa la probabilidad de presencia en una región
delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La
gráfica siguiente muestra los orbitales para los primeros niveles de energía
disponibles en el átomo de hidrógeno y oxígeno.
Gilbert Newton Lewis
Teoría de Ácidos y Bases
de Gilbert Newton Lewis (1875- 1946) fue un químico estadounidense que
inventó la teoría del enlace covalente. Nació en Weymouth, Massachusetts, y
estudió en las universidades de Nebraska, Harvard, Leipzig y Gotinga. Enseñó
química en Harvard desde 1899 hasta 1900 y desde 1901 hasta 1906, y en el
Instituto de Tecnología de Massachusetts desde 1907 a 1912. A partir de ese año
y hasta su muerte fue profesor de química física en la Universidad de
California en Berkeley, y también fue decano de la Escuela de Química.
La historia del desarrollo de la
teoría de los ácidos y bases no estaría completa sin al menos un breve vistazo
al modelo de Lewis de los ácidos y bases. En el año de 1923 Lewis propuso el
concepto más general de ácidos y bases y también introdujo el uso de las
fórmulas del electrón – punto. De hecho, el empleo de pares electrónicos en la
escritura de fórmulas químicas es también la base del modelo ácido - base de
Lewis. Según Lewis, las definiciones para ácidos y bases son:
Un ácido de Lewis es una sustancia
capaz de aceptar (y compartir) un par electrónico.
Un ácido de Lewis es una sustancia
capaz de donar (y compartir) un par electrónico.
Todas las sustancias químicas que son
ácidos según las teorías de Arrhenius y de Bronsted Lowry también lo son de
acuerdo con la teoría de Lewis. Todas las sustancias que son bases según las
teorías de Arrhenius y de Bronsted – Lowry lo son también de acuerdo con la
teoría de Lewis. Según esta teoría, un ión hidrógeno, H+, no deja de ser un
ácido, y un ión hidróxido, OH-, es todavía una base, pero las definiciones de
Lewis expanden el modelo ácido – base más allá de los modelos de Bronsted y
Arrhenius.
Las definiciones de Lewis de los
ácidos y bases tienen una importancia especial en la química orgánica, pero las
definiciones de Arrhenius o de Bronsted – Lowry son por lo general adecuadas
para explicar las reacciones en solución acuosa.
Ejemplo de la teoría de Lewis:
- El amoníaco se comporta como una
base, pues es capaz de ceder un par de electrones al trifluoruro de boro para
formar un par ácido-base:
H3N + BF3 <-> H3N-BF3
H3N + BF3 <-> H3N-BF3
Teoría ácido-base de Lewis
Gilbert Newton Lewis químico
estadounidense que en 1938 formuló la teoría del enlace covalente
donde propuso que no todas las reacciones ácido-base implican
transferencia de protones, pero sin embargo forman siempre un enlace covalente
dativo.
Propuso la escritura de fórmulas
utilizando puntos para resaltar los electrones.
Ácido: Sustancia que puede aceptar
un par de electrones de otros grupos de átomos, para formar un enlace covalente
dativo. (H+)
Base: Sustancia que tiene pares
de electrones libres, capaces de ser donados para formar enlaces
covalentes dativos. (OH-)
El ácido debe tener su octeto de electrones
incompleto y la base debe tener algún par de electrones solitarios. La
reacción de un ácido con una base de Lewis da como resultado un compuesto de
adición.
Todas las sustancias químicas que son
ácidos o bases según las teorías de Arrhenius y de Brönsted Lowry también lo
son de acuerdo con la teoría de Lewis; pero muchos ácidos de Lewis, no lo son
de Brönsted, ejemplo:
(BF3 + :NH3 → F3B NH3).
Bases de LEWIS
Las
definiciones de Arrhenius o de Brönsted - Lowry son por lo general adecuadas
para explicar las reacciones en solución acuosa.
También
existen sustancias de Lewis, que pueden actuar como ácidos y bases a la vez, es
decir, son anfóteras (ej: óxido de aluminio).
Según
la teoría de Lewis, un ión hidrógeno (H+), invariablemente será un ácido, y un
ión hidróxido, (OH-), siempre será una base; pero las definiciones de Lewis
amplían el modelo ácido - base por lo que tienen gran importancia en la química
orgánica ya que el concepto de Lewis además identifica como ácidos ciertas
sustancias que no contienen hidrógeno y que tienen la misma función que
los ácidos comunes que contienen hidrógeno.
Ej: SO3 + (O)-2 --> (SO4)-2 donde el SO3 actúa como ácido y el (SO4)-2 como base.
O
en la reacción AlCl3 + Cl- --> AlCl4- donde
el tricloruro de aluminio actúa como ácido y el ion tetracloruro de aluminio
como base.
Muchos
de los ácidos de Lewis, son importantes catalizadores en diversas reacciones
orgánicas.
Lewis
determinó una base como una sustancia que posee un par de
electrones sin compartir, con el cual puede formar un enlace covalente con un
átomo, una molécula o un ión. Un ácido es una sustancia que
puede formar un enlace covalente aceptando un par de electrones de la
base.
Para
los ácidos y las bases de Lewis, existen reglas cualitativas que nos permiten
poder predecir la fuerza de una sustancia, y estimar incluso, que tipo de base
preferirá un ácido concreto o viceversa. Estas reglas se pueden dividir en:
Bases
fuertes, son aquellas sustancias que tienen un átomo que cede, cuya densidad
electrónica se deforma difícilmente (polariza), debido a esto, por lo general,
el átomo dador es de pequeño tamaño y bastante electronegativo. Ej: F-, OH-, O-2
Bases
débiles, en cambio, son aquellas sustancias que poseen un átomo dador cuya
densidad electrónica se deforma fácilmente. Dichos átomos suele ser menos
electronegativos, y de mayor tamaño que en las bases fuertes. Por ejemplo: Br-,
I-, CN-, CO-
Las
sustancias que son bases en el sistema de Brönsted también son bases de acuerdo
con el sistema de Lewis. No obstante, la definición de Lewis de un ácido
amplía el número de sustancias que se clasifican como ácidos.
Un ácido
de Lewis posee un orbital desocupado capaz de aceptar pares de electrones
de la base.
Las
especies químicas que funcionan como ácidos de Lewis, incluyen:
Moléculas
o átomos que posean octetos incompletos, varios cationes sencillos,
algunos átomos metálicos y los compuestos que tienen átomos centrales capaces
de extender sus niveles de valencia.
En
general, los ácidos que forman mejor los enlaces con las bases fuertes, reciben
el nombre de ácidos fuertes, y los ácidos que forman mejores enlaces con las
bases débiles, reciben el nombre de ácidos débiles.
Ácidos fuertes de
Lewis: H+ Li+ Na+ K+ Be+2 Mg+2 Ca+2
Sr+2 Sn+2 Al+3 Si+4
Ácidos débiles
de Lewis: Cu+ Ag+ Au+ Ti+ Hg+ Cs+ Pd+2
Cd+2 Pt+2 Hg+2
Diferencias
de las teorías ácido base:
Teoría
|
Arrhenius
|
Brönsted-Lowry
|
Lewis
|
Definición
de ácido
|
Cede
H+ en agua
|
Cede
H+
|
Captador
de e-
|
Definición
de base
|
Cede
OH- en agua
|
Acepta
H+
|
Donador
de e-
|
Neutralización
|
Formación
de agua
|
Transferencia
de H+
|
Formación
de enlace covalente coordinado
|
Ecuación
|
H+ +
OH- → H2O
|
HA
+ B- → A- + BH
|
A+
+ B- → A-B
|
Limitación
|
Solo
soluciones acuosas
|
Solo
transferencia de H+
|
Teoría
general
|
Svante August Arrhenius
Teoría
de Ácidos y Bases.
Svante August Arrhenius (1859-1927)
fue un químico suizo que estudiaba en la escuela para graduados. Nació cerca de
Uppsala, estudió en la Universidad de Uppsala y se doctoró el año 1884.
Mientras todavía era un estudiante, investigó las propiedades conductoras de
las disoluciones electrolíticas (que conducen carga). En su tesis doctoral
formuló la teoría de la disociación electrolítica. Él definió los ácidos como
sustancias químicas que contenían hidrógeno, y que disueltas en agua producían
una concentración de iones hidrógeno o protones, mayor que la existente en el
agua pura. Del mismo modo, Arrhenius definió una base como una sustancia que
disuelta en agua producía un exceso de iones hidroxilo, OH-. La reacción de
neutralización sería:
H+ + OH- -> H2O
La teoría de Arrhenius ha sido objeto de críticas. La primera es que el concepto de ácidos se limita a especies químicas que contienen hidrógeno y el de base a las especies que contienen iones hidroxilo. La segunda crítica es que la teoría sólo se refiere a disoluciones acuosas, cuando en realidad se conocen muchas reacciones ácido-base que tienen lugar en ausencia de agua.
En los tiempos de Arrhenius se
reconocía a los ácidos en forma general como sustancias que, en solución
acuosa.
Tienen un sabor agrio si se diluyen
los suficiente para poderse probar.
Hacen que el papel tornasol cambie de
azul a rojo.
Reaccionan con los metales activos
como el magnesio, zinc y hierro produciendo hidrógeno gaseoso, H2 (g).
Reaccionan con los compuestos llamados
bases (contienen iones hidróxido, OH-) formando agua y compuestos llamados
sales. La sal que se forma está compuesta por el ion metálico de la base y el
ion no metálico del ácido. Casi todas las sales son sólidos cristalinos de alto
punto de fusión y de ebullición.
La reacción de un ácido con una base
se llama neutralización. Si se mezclan las cantidades correctas de ácidos y
bases, se pierden sus propiedades originales. El producto de reacción tiene un
sabor que no es agrio ni amargo, sino salado. Se produce una sal y agua cuando
un ácido neutraliza una base.
Arrhenius propuso que las propiedades características de los ácidos con en realidad propiedades del ion hidrógeno, H+, y que los ácidos son compuestos que liberan iones hidrógeno en las soluciones acuosas.
Arrhenius y otros científicos reconocían en términos generales que las bases (también llamadas álcalis) son sustancias que, en solución acuosa,
Tienen un sabor amargo.
Se sienten resbalosas o jabonosas al
tacto.
Hacen que el papel tornasol cambie de
rojo a azul.
Reaccionan con lo ácidos formando agua
y sales.
Arrhenius explicó que estas
propiedades de las bases (álcalis) eran en realidad propiedades del ion
hidróxido, OH-. Propuso que las bases con compuestos que liberan iones
hidróxido en solución acuosa. Las definiciones de Arrhenius son útiles en la
actualidad, siempre y cuando se trate de soluciones acuosas.
Acidos y bases de Arrhenius:
Los ácidos liberan iones hidrógeno en
agua.
Las bases liberan iones hidróxido en
agua.
Ejemplo de la teoría de Arrhenius:
- El ácido Clorhídrico , HCl (ac)
reacciona con el magnesio metálico produciendo hidrógeno gaseoso y cloruro de
magnesio
2 HCl (ac) +
ESTRUCTURA
Y COMPOSICIÓN DE LA MATERIA
MATERIA
La
materia es todo lo que ocupa un lugar en el universo. Es todo aquello que se
forma a partir de átomos o moléculas, con la propiedad de estar en estado
sólido, líquido o gaseoso. Son ejemplos de materia las piedras, la madera, los
huesos, el plástico, el vidrio, el aire y el agua. Al observar un paisaje
pueden verse pájaros, árboles, un río, un caballo pastoreando, flores, etc.
Todas esas cosas forman parte de la naturaleza y se pueden ver y tocar. Esa
característica común (visible y palpable) que tienen todos los objetos se
denomina materia. Es decir, la materia es lo que forman las cosas que tocamos y
vemos.
La materia tiene volumen porque ocupa un lugar en el espacio. Además tiene masa, que es la cantidad de materia que posee un objeto y que se puede medir con una balanza. La materia, a diferencia de los objetos o cuerpos, no está limitada por la forma ni por el tamaño. A su vez, los objetos o cuerpos (por ejemplo una caja) pueden estar construidos por diferentes materiales (cartón, metal, madera, plástico). Además, un mismo objeto puede estar formado por uno o varios materiales (caja de madera con tapa de plástico y cerradura de metal). También, diferentes objetos pueden estar fabricados con el mismo tipo de material (balde, pelota y botella de plástico).En el universo, la materia suele encontrarse en tres estados diferentes de agregación: sólido (hierro, madera), líquido (agua de mar) y gaseoso (aire atmosférico). En estos tres estados de agregación se observan las siguientes características:
1) La materia está formada por pequeñas partículas.
2) Esas partículas están en constante movimiento (en los gases más que en los líquidos y sólidos).
3) Hay fuerzas de atracción entre las partículas que forman la materia (en los sólidos más que en líquidos y gases).
Esas partículas, que son pequeñísimas y que forman parte de la materia se denominan átomos.
ÁTOMO
Un
átomo es la menor cantidad de un elemento químico que tiene existencia propia,
y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño
que una sola gota de agua contiene más de mil trillones de átomos. Los átomos
están formados por un núcleo que contiene dos tipos de partículas: los protones
(tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica).
Ambas partículas tienen una masa similar.
Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica
negativa y una masa muchísimo más pequeña que la correspondiente a los protones
y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones
como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo
en zonas llamadas orbitales, que se agrupan en niveles de energía. Los
electrones que giran más cercanos al núcleo del átomo tienen menor energía que
aquellos que lo hacen alejados del núcleo. Los electrones van llenando los
orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa
forma, el último nivel que contenga electrones puede estar completo o
incompleto.
Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica.
El átomo que gana electrones (queda
cargado negativamente) se denomina anión. El átomo que pierde electrones (queda
cargado positivamente) se llama catión.
Tanto el anión como el catión reciben
el nombre de "iones".
Es decir, un ion es un átomo cargado
eléctricamente, sea en forma positiva o negativa.
John Dalton propuso la denominada
“Teoría Atómica” en el año 1808, donde se postula:
1- La materia está formada por partículas indivisibles y pequeñas llamadas átomos.
2- Un elemento químico es un tipo de materia formada por una sola clase de átomos.
3- Cuando los átomos de dos o más elementos se combinan forman compuestos en una razón fija de números enteros.
4- Durante una reacción química, ningún átomo desaparece o se transforma en átomos de otro elemento.
La teoría atómica dio lugar a tres leyes de la materia.
-Ley de la conservación de la masa: durante los cambios químicos no se producen modificaciones apreciables en la masa.
-Ley de la composición constante: un compuesto contiene siempre los mismos elementos y en igual razón por peso, independientemente de su origen.
-Ley de las proporciones múltiples: cuando dos elementos forman dos compuestos distintos, la relación de masa de los elementos en un compuesto está asociada a la relación de masa en el otro compuesto a través de un número sencillo y entero.
MOLÉCULA
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia.
Por ejemplo, la menor porción de
agua que puede existir en estado libre y conservar las propiedades del agua es
la formada por 1 átomo de oxígeno y 2 de hidrógeno. La molécula es una
estructura formada a partir de la unión de dos o más átomos que comparten
electrones. A temperatura ambiente hay moléculas sólidas (cloruro de sodio o
sal común), líquidas (agua) y gaseosas (dióxido de carbono).
En síntesis, la
materia está formada por partes muy pequeñas llamadas átomos. Los átomos se
reúnen para constituir moléculas. A su vez, las moléculas se unen para formar
sustancias. El suelo, el aire y el agua no tienen vida. Pertenecen al mundo
mineral o inorgánico.
La materia que forma el agua, suelo y
aire se llama materia inorgánica. El árbol, el caballo y el humano, entre
otros, pertenecen al mundo de los seres vivos. La materia que los forma se
llama materia orgánica. Los compuestos o sustancias orgánicas son aquellos que
comprenden a los hidrocarburos y sus derivados. Los hidrocarburos son elementos
formados por átomos de carbono y de hidrógeno.
Las sustancias inorgánicas comprenden
a los restantes compuestos químicos que, en general, se encuentran en la
naturaleza como minerales.
MOLÉCULA DE AGUA
MOLÉCULA DE OXIGENO
PROPIEDADES DE LA MATERIA
MÉTODOS DE SEPARACIÓN DE MEZCLAS
Los métodos de separación de mezclas más comunes son los
siguientes:
1. Decantación: se utiliza en
mezclas heterogéneas de dos líquidos o de un sólido en un líquido. Este método
físico se basa en las diferentes densidades de los componentes. La mezcla se
deja reposar hasta que descienda uno de los constituyentes y pueda extraerse.
Las suspensiones se separan por decantación, tal los casos del agua en aceite o
el agua con tierra.
3. Imantación: cuando uno de
los componentes de la mezcla es atraído por los imanes, no así la otra, por
ejemplo partículas de hierro mezcladas con arena.
4. Extraccion: Separa una sustancia que se puede
disolver en dos disolventes entre sí, con un diferente grado de solubilidad. Al
realizar estas concentraciones de esta sustancia a cada disolvente a una temperatura específica,
es constante.
5. Tamización: procedimiento
donde las partículas sólidas se pueden separar a raíz de su diferente tamaño.
Se utilizan coladores con orificios de distintas
6. Evaporización o
Cristalización: Se usa para separar un líquido de un sólido disuelto en
el, por el calor o la disminución de la presión. La evaporación
se puede producir a cualquier temperatura, pero cuánto más elevada este, es más
rápido realizarlo.
7. Destilación: Sirve para
separar dos líquidos que se pueden mezclar entre sí, que tiene diferente punto
de ebullición. Esta técnica se utiliza para purificar o separar los líquidos de
una mezcla líquida. Se basa en las técnicas de densidades que hay
entre cada componente.
8. Cromatografía: Es un
fluido que a través de una fase, trata de que un sólido o un líquido estén
fijados en un sólido. Se utiliza y se conoce como el método más simple ya que
sus componentes se separan o manifiestan sus distintas afinidades por el filtro.
9. Centrifugación: Puede separar
sólidos de líquidos de distinta densidad a través de una fuerza centrífuga.
La fuerza de está es provista por la máquina llamada centrifugadora, que
imprime a la mezcla el movimiento de rotación que aplica una fuerza
que origina la sedimentación de los sólidos.
10. Dimensiones: Por este método, por
ejemplo, se pueden separar pequeñas rocas mezcladas con arena gruesa y con sal.
LEY DEL OCTETO:
Esta regla indica que cuando se van a
enlazar dos átomos iguales, los electrones de valencia de éstos
se organizan de tal manera que, al formar el enlace por compartición de
pares de electrones, cada uno de los átomos al final adopta una estructura de
gas noble, quedando ambos rodeados de 8 electrones en sus últimos niveles
de energía. Cuando se trata de átomos diferentes, el elemento más
electronegativo o no metálico es el que se rodea de ocho electrones.
Esta Regla tiene algunas excepciones
como es el caso de que no se aplica en la formación de enlaces con pares
de átomos de hidrógeno.
Aplicación de la regla dl octeto con
átomos de elementos diferentes:
Regla del
Octeto y Electrones de Valencia
Capa de
Valencia
Representación
del último nivel de energía de la configuración electrónica de un elemento
, incluyendo únicamente los orbitales “ s y p”. Por
ejemplo el Mg :
Configuración Capa
de Valencia
12Mg
1s2/2s22p6/3s2 3s2
Electrones
de Valencia
Electrones que se encuentran en la Capa de Valencia.
Por ejemplo el magnesio que tiene una capa de valencia 3s2 , tiene 2 electrones de valencia.
Elemento Capa de
Valencia Electrones de Valencia
Mg 3s2 2
Cl 3s2 3p5 7
Al 3s2 3p1 3
O 2s2 2p4 6
Estructura
de LEWIS
La estructura de Lewis es la representación gráfica del símbolo del elemento con los electrones de valencia alrededor del símbolo, empleando puntos o asteríscos.
El número
de electrones de valencia de los elementos representativos es igual al grupo
donde se encuentran.
Un átomo
puede tener una o más estructuras de Lewis, que corresponde a las diferentes
posibilidades de acomodo de los electrones de valencia.
Alrededor del simbolo existen cuatro lados imaginarios (un cuadrado) y existe
la capacidad de dos electrones por lado (la estructura de Lewis de un átomo
puede tener hasta 8 electrones de valencia).
Regla del
octeto
En la representación de la estructura de Lewis de un átomo individual, el máximo de electrones que pueden representarse alrededor del símbolo son 8, los únicos que cumplen con esta condición son los gases nobles (grupo VIII A).
En la representación de la estructura de Lewis de un átomo individual, el máximo de electrones que pueden representarse alrededor del símbolo son 8, los únicos que cumplen con esta condición son los gases nobles (grupo VIII A).
Cuando los átomos se unen para formar moléculas, los únicos que completan el octeto o los ocho electrones son los elementos no metálicos (los que se escriben a la derecha en las moléculas binarias y en el centro en las ternarias).La regla del octeto se aplica cuando se escribe la estructura de Lewis de un compuesto.
Valencia
Número de electrones encontrados en el nivel más externo de un átomo (último nivel de energía), que pueden compartirse con otro átomo para formar enlaces químicos.
Número de electrones encontrados en el nivel más externo de un átomo (último nivel de energía), que pueden compartirse con otro átomo para formar enlaces químicos.
La
valencia puede ser negativa o positiva, positiva cuando tenga menos de
4 electrones y es capaz de donarlos y negativa cuando tiene más de
4 electrones y tiene la capacidad de aceptar electrones para completar el
octeto.
Elemento
|
Electrones de Valencia
|
VALENCIA
|
Mg
|
2
|
+2
|
Cl
|
7
|
-1
|
Al
|
3
|
+3
|
O
|
6
|
-2
|
Por
ejemplo, el Al del grupo III A, tiene 3 electrones de Valencia, su valencia es
+3 y el cloro del grupo VIIA tiene 7 electrones de valencia y su valencia es -1
.
Al+3
Cl-1 Al+3Cl-13
AlCl3
La Valencia se
representa con un signo que indica si se ganan (-) o se pierden (+)
electrones, y por un número que son la cantidad de electrones ganados
o perdidos.En el ejemplo anterior un átomo de aluminio se enlaza con tres
átomos de cloro, el aluminio cede un electrón a cada cloro (3 electrones en
total) y cada uno de los cloros aceptan un electrón.
La Valencia se
define también, como la capacidad de combinación de un á
Por
ejemplo el Magnesio ,con Valencia +2 , se combina con dos átomos de bromo a la
vez, y el bromo que tiene valencia -1, se combina con un átomo a la vez.
Mg+2
Br-1 Mg+2Br-12
MgBr2
Las
moléculas tienen naturaleza neutra y para balancear las cargas o
valencias se emplean los subíndices.
Al
escribir las moléculas, el metal va a la izquierda con valencia positiva y el
no metal del lado derecho con valencia negativa.
Na+1Cl-1 El metal es
el sodio y el no metal es el cloro.
Ejemplo: cuando se enlazan dos
átomos de cloro (7 electrones de valencia) comparten dos electrones de valencia
para que cada átomo alcance 8 electrones de valencia.
La razón de la regla del octeto es que los átomos buscan adquirir una
configuración electrónica similar a la de un gas noble (Grupo VIIIA de la tabla
periódica), ya que de este modo alcanzan mayor estabilidad. La configuración
electrónica de los gases nobles es la más estable de todos los elementos ya que
al tener 8 electrones de valencia, todos los orbitales de su último nivel
quedan llenos.
CLASIFICACIÓN CIENTÍFICA DEL CONOCIMIENTO DE LOS MATERIALES.
Stanislao Cannizzaro
(Palermo, 13
de julio de 1826 – Roma, 10 de mayo de 1910)
fue un químico y gobernador italiano que resolvió las
confusiones surgidas acerca de las masas moleculares y atómicas.
APORTACIONES
1er fuente :La tabla periódica se
descubrió gracias al químico italiano Stanislao Cannizzaro (1826-1910). En 1858
publicó una lista de pesos atómicos fijos (que ahora se conocen como masas
atómicas relativas) para los sesenta elementos que entonces se conocían. Al
ordenar los elementos de menor a mayor peso atómico, las propiedades químicas
se repetían curiosamente a intervalos regulares.
2da fuente : El problema de la determinación de los pesos atómicos quedó resuelto en 1858 por el químico italiano Stanislao Cannizzaro (1826-1910) quien reafirmó el concepto de molécula propuesto anteriormente por Avogadro. En un sentido amplio, las moléculas son agregados de átomos, los compuestos están formados por moléculas y por lo tanto, el peso molecular de un compuesto será el peso de una mole de moléculas. Cannizzaro encontró que el peso molecular (M) de un compuesto gaseoso es aproximadamente el doble de su densidad relativa respecto al Hidrógeno, y que el peso atómico de un elemento es el peso más pequeño del mismo contenido en un peso molecular de cualquiera de sus compuestos.
Stanislao Cannizzaro puso de manifiesto el hecho de que algunos elementos (por
ejemplo el oxígeno) poseen moléculas que contienen dos átomos. Esta aclaración
permitió que los químicos consiguieran una "lista" consistente de los
elementos.
Dmitri Ivanovich Mendeléiev
(Tobolsk, actual Rusia, 1834-San
Peterburgo, 1907) Químico ruso. Su familia, de la que era el menor de
diecisiete hermanos, se vio obligada a emigrar de Siberia a Rusia a causa de la
ceguera del padre y de la pérdida del negocio familiar a raíz de un incendio.
Su origen siberiano le cerró las puertas de las universidades de Moscú y San
Petersburgo, por lo que se formó en el Instituto Pedagógico de esta última
ciudad.
Más tarde se trasladó a Alemania, para
ampliar estudios en Heidelberg, donde conoció a los químicos más destacados de
la época. A su regreso a Rusia fue nombrado profesor del Instituto Tecnológico
de San Petersburgo (1864) y profesor de la universidad (1867), cargo que se
vería forzado a abandonar en 1890 por motivos políticos, si bien se le concedió
la dirección de la Oficina de Pesos y Medidas (1893).
Entre sus trabajos destacan los
estudios acerca de la expansión térmica de los líquidos, el descubrimiento del
punto crítico, el estudio de las desviaciones de los gases reales respecto de
lo enunciado en la ley de Boyle-Mariotte y una formulación más exacta de la
ecuación de estado. En el campo práctico destacan sus grandes contribuciones a
las industrias de la sosa y el petróleo de Rusia.
Con todo, su principal logro
investigador fue el establecimiento del llamado sistema periódico de los
elementos químicos, o tabla periódica, gracias al cual culminó una
clasificación definitiva de los citados elementos (1869) y abrió el paso a los
grandes avances experimentados por la química en el siglo XX.
Aunque su sistema de clasificación no
era el primero que se basaba en propiedades de los elementos químicos, como su
valencia, sí incorporaba notables mejoras, como la combinación de los pesos
atómicos y las semejanzas entre elementos, o el hecho de reservar espacios en
blanco correspondientes a elementos aún no descubiertos como el eka-aluminio o
galio (descubierto por Boisbaudran, en 1875), el eka-boro o escandio (Nilson,
1879) y el eka-silicio o germanio (Winkler, 1886).
Mendeléiev demostró, en controversia
con químicos de la talla de Chandcourtois, Newlands y L. Meyer, que las
propiedades de los elementos químicos son funciones periódicas de sus pesos
atómicos. Dio a conocer una primera versión de dicha clasificación en marzo de
1869 y publicó la que sería la definitiva a comienzos de 1871. Mediante la
clasificación de los elementos químicos conocidos en su época en función de sus
pesos atómicos crecientes, consiguió que aquellos elementos de comportamiento
químico similar estuvieran situados en una misma columna vertical, formando un
grupo. Además, en este sistema periódico hay menos de diez elementos que ocupan
una misma línea horizontal de la tabla. Tal como se evidenciaría más adelante,
su tabla se basaba, en efecto, en las propiedades más profundas de la
estructura atómica de la materia, ya que las propiedades químicas de los
elementos vienen determinadas por los electrones de sus capas externas.
Convencido de la validez de su
clasificación, y a fin de lograr que algunos elementos encontrasen acomodo
adecuado en la tabla, Mendeléiev «alteró» el valor de su peso atómico
considerado correcto hasta entonces, modificaciones que la experimentación confirmó
con posterioridad. A tenor de este mismo patrón, predijo la existencia de una
serie de elementos, desconocidos en su época, a los que asignó lugares
concretos en la tabla.
Pocos años después (1894), con el
descubrimiento de ciertos gases nobles (neón, criptón, etc.) en la atmósfera,
efectuado por el químico británico William Ramsay (1852-1816), la tabla de
Mendeléiev experimentó la última ampliación en una columna, tras lo cual quedó
definitivamente establecida.
TABLA PERIÓDICA ANTIGUAS Y
MODERNA
TU DECIDES:
¿QUE MATERIALES UTILIZAR PARA CONDUCIR LA CORRIENTE ELÉCTRICA?
Conductividad es la propiedad de aquello que es conductivo (es
decir, que tiene la facultad de conducir). Se trata de una propiedad física que
disponen aquellos objetos capaces de transmitir la electricidad o el
calor.
La conductividad eléctrica, por lo
tanto, es la capacidad de los cuerpos que permiten el paso de la corriente a
través de sí mismos. Esta propiedad natural está vinculada a la facilidad con
la que los electrones pueden
atravesarlos y resulta inversa a la resistividad.
Es importante diferenciar entre la conductividad y
la conductancia (la aptitud de un cuerpo para conducir la corriente
entre distintos puntos). La conductancia es la propiedad de la resistencia.
En los líquidos, la conductividad está vinculada a
la existencia de sales en etapa de solución ya que, con su
disociación, se producen iones negativos y positivos que pueden trasladar la
energía eléctrica cuando el líquido es sometido a un campo eléctrico. Dichos
conductores iónicos reciben el nombre de electrolitos.
En el caso de los sólidos, los materiales con
capacidad de conductividad son los que tienen bandas de valencia que
se superponen con la conducción y crean una nube de electrones libres que
generan la corriente al estar sometidos al campo eléctrico.
ESTRUCTURA Y ORGANIZACIÓN DE LA INFORMACIÓN FÍSICA Y QUÍMICA EN LA TABLA PERIÓDICA.
La tabla periódica de los
elementos clasifica, organiza y distribuye los distintos elementos
químicos conforme a sus propiedades y características; su función
principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a Dmitri
Mendeléyev, quien ordenó los elementos basándose en las propiedades químicas de
los elementos,1si
bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un
ordenamiento a partir de las propiedades físicas de los átomos. La
estructura actual fue diseñada por Alfred Werner a partir de la
versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005)
presentó una nueva versión basada en la estructura electrónica de los
elementos, la cual permite colocar las series lantánidos y los actínidos en una
secuencia lógica de acuerdo con su número atómico.
Todos los elementos tienen como maximo
dos letras y la segunda debe ser minuscula para evitar confuciones.
Si no fuera asi, ¿podrias distinguir
entre CASy CaS?
te confundirias entre carbono, calcio,
arcenico, y azufre, por eso la primera letra siempre sera mayuscula y la
segunda minuscula.
El tercer dato util es el numero
atomico, es el numero que se ve arriba a la izquierda en el cuadro
correspondiente a cada elemento.
CLASIFICACIÓN DE LA TABLA PERIÓDICA
ESTRUCTURA Y ORGANIZACIÓN DE LA
TABLA PERIÓDICA
La tabla periódica actual es un
sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan
de izquierda a derecha y de arriba a abajo en orden creciente de sus números
atómicos. Los elementos están ordenados en siete hileras horizontales llamadas
periodos, y en 18 columnas verticales llamadas grupos o familias.
GRUPOS
A las columnas verticales de la tabla
periódica se les conoce como grupos o familias. Hay 18 grupos en la tabla
periódica estándar, de los cuales diez son grupos cortos y los ocho restantes
largos, que muchos de estos grupos correspondan a conocidas familias de
elementos químicos: la tabla periódica se ideó para ordenar estas familias de
una forma coherente y fácil de ver.
Todos los elementos que pertenecen a
un grupo tienen la misma valencia atómica, entendido como el número de
electrones en la última capa, y por ello, tienen propiedades similares entre
sí.
La explicación moderna del
ordenamiento en la tabla periódica es que los elementos de un grupo
poseen configuraciones electrónicassimilares y la misma valencia
atómica, o número de electrones en la última capa. Dado que
las propiedades químicas dependen profundamente de las interacciones
de los electrones que están ubicados en los niveles más externos, los elementos
de un mismo grupo tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo
1 tienen una configuración electrónica ns1 y una valencia de 1 (un
electrón externo) y todos tienden a perder ese electrón al enlazarse
como iones positivos de +1. Los elementos en el último grupo de la
derecha son los gases nobles, los cuales tienen lleno su último nivel de
energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son
también llamados gases inertes.
Numerados de izquierda a derecha
utilizando números arábigos, según la última recomendación de
la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre
paréntesis según el sistema estadounidense, los grupos de la tabla periódica
son:
Grupo 1 (I A): los metales
alcalinos
Grupo 2 (II A): los metales
alcalinotérreos.
Grupo 3 (III B): familia del Escandio
Grupo 4 (IV B): familia del Titanio
Grupo 5 (V B): familia del Vanadio
Grupo 6 (VI B): familia del Cromo
Grupo 7 (VII B): familia delManganeso
Grupo 8 (VIII B): familia del Hierro
Grupo 9 (VIII B): familia del Cobalto
|
Grupo 10 (VIII B): familia del Níquel
Grupo 11 (I B): familia del Cobre
Grupo 12 (II B): familia del Zinc
Grupo 13 (III A): los térreos
Grupo 14 (IV A): los carbonoideos
Grupo 15 (V A): los nitrogenoideos
Grupo 16 (VI A): los calcógenos oanfígenos
Grupo 17 (VII A): los halógenos
Grupo 18 (VIII A): los gases nobles
|
PERIODOS
Las filas horizontales de la tabla
periódica son llamadas períodos. El número de niveles energéticos de
un átomo determina el periodo al que pertenece. Cada nivel está
dividido en distintos subniveles, que conforme aumenta sunúmero atómico se
van llenando en este orden:
Siguiendo esa norma, cada elemento se
coloca según su configuración electrónica y da forma a la tabla
periódica. Los electrones situados en niveles más externos
determinan en gran medida las propiedades químicas, por lo que éstas
tienden a ser similares dentro de un mismo grupo, sin embargo la masa
atómica varía considerablemente incluso entre elementos adyacentes. Al
contrario, dos elementos adyacentes de mismo periodo tienen una masa similar,
pero propiedades químicas diferentes.
La tabla periódica consta de 7
períodos:
· Período 1
· Período 2
· Período 3
· Período 4
|
· Período 5
· Período 6
· Período 7
|
BLOQUES:
La tabla periódica se puede también dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos, de acuerdo al principio de Aufbau.
La tabla periódica se puede también dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos, de acuerdo al principio de Aufbau.
Los bloques o regiones se denominan
según la letra que hace referencia al orbital más externo: s, p, d y f.
Podría haber más elementos que llenarían otros orbitales, pero no se han
sintetizado o descubierto; en este caso se continúa con el orden alfabético
para nombrarlos.
COMO SE UNEN LOS ÁTOMOS.
La unión entre átomos se produce
mediante el enlace químico que se realiza mediante los electrones de la última
capa (electrones de valencia).
Enlace químico es la fuerza que mantiene unidos a los átomos dentro de la molécula de una sustancia estable.
Hay distintos tipos de enlaces pero en cualquiera de ellos los átomos unidos adoptan una estructura más estable que cuando están libres.
En gran medida las propiedades
químicas de los elementos y compuestos dependen de la manera en que los átomos
que los constituyen se encuentran enlazados.
Hay tres tipos de enlaces
Enlace iónico
Enlace Covalente
Enlace Metálico
La mayoría de las sustancias, sean
extraídas de la naturaleza o fabricadas en laboratorios, están constituidas por
más de una clase de átomo, es decir, por más de un elemento químico. Esto
implica que existe una gran diversidad de agregados de átomos unidos entre sí
–de diferentes formas y en distintas proporciones- mediante fuerzas que se
denominan uniones químicas interatómicas. Cuando dos o más átomos iguales
o diferentes se unen entre sí formando una agrupación estable dan lugar a una
molécula, de esta forma alcanzan un estado de mayor estabilidad que
si estuviesen separados. Si los átomos están unidos en forma estable, la
sustancia que forman también es estable, y por lo tanto no tienen tendencia a
reaccionar químicamente de manera espontánea; esto significa que sus átomos no
tienden a separarse para formar otros agregados diferentes, a menos que se
provoque dicha separación.
Cada molécula de una sustancia compuesta constituye la porción más pequeña de materia que conserva las propiedades químicas de dicha sustancia. O en otros términos, las sustancias compuestas puras pueden ser consideradas como conjuntos de moléculas iguales.
Así, los gases Hidrógeno (H2) y oxígeno (O2) están constituidos por moléculas diatómicas en las cuales los dos átomos componentes son esencialmente iguales; el agua está formada por moléculas que se producen por la unión de dos átomos de hidrógeno y uno de oxígeno (H2O); en el gas metano (CH4) cuatro átomos de hidrógeno se enlazan con uno de carbono para formar la correspondiente molécula.
Se llama enlace químico al conjunto de
fuerzas que mantienen unidos los átomos, iones y moléculas, cuando forman distintas
agrupaciones estables. En la formación de un enlace químico participan sólo los
electrones del último nivel de los átomos, es decir, los electrones de
valencia. Siempre que se forme un enlace se desprenderá energía, mientras que
para romper un enlace será necesario suministrar energía, denominada energía de
enlace. Los sistemas más estables son los que contienen menos energía.
La electronegatividad (EN) es una medida de la capacidad que tiene un átomo para atraer electrones en un enlace químico. Según su electronegatividad, los elementos químicos pueden ser electronegativos y electropositivos.
Los Electronegativos son aquellos que tienden a ganar electrones. Los no metales son elementos electronegativos.
Los Electropositivos son aquellos que tienden a perder o ceder electrones. Los metales son elementos electropositivos.
Para que el enlace químico se mantenga es necesario que el grupo de átomos sea más estable que los átomos por separado, los cuales para lograr ese estado ideal, suelen utilizar una o varias estrategias: ceder o captar electrones, compartir electrones con otro átomo o ponerlo en común junto con otros. De esta estrategias surgen los tres tipos de enlace químico: Iónico, Covalente y Metálico.
TIPOS DE ENLACES
Los átomos se unen entre sí para
formar moléculas mediante fuerzas de enlace.
Enlace iónico
Se representa un enlace ionico generalmente cuando se lleva acabo una combinacion quimica entre metal y un no metal.
Como por ejemplo el Cloruro de Sodio (NaCl) es un compuesto ionico formado por un metal (el Sodio, Na) y un no metal (el Cloro, Cl) el numero atomico del Sodio es 11, por lo tanto, consta de 11 protones y 11 electrones. los Protones tienen cargas Positivas y los Electrones cargas Negativas, por lo que el sodio con 11 protones y 11 electrones es Elctricamente Neutro, es decir, carece de cargas. tiene un electron de valencia.
El enlace iónico consiste
en la atracción electrostática entre átomos con cargas eléctricas de signo
contrario. Este tipo de enlace se establece entre átomos de elementos poco
electronegativos con los de elementos muy electronegativos. Es necesario que
uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha
dicho anteriormente este tipo de enlace se suele producir entre un no metal
(electronegativo) y un metal (electropositivo).
Se
produce una transferencia electrónica, cuyo déficit se cubre sobradamente con
la energía que se libera al agruparse los iones formados en una red cristalina
que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices
del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma
cada ion Cl-queda rodeado de seis iones Na+ y recíprocamente. Se llama
índice de coordinación al número de iones de signo contrario que rodean a uno
determinado en una red cristalina. En el caso del NaCl, el índice de
coordinación es 6 para ambos
Los
dos factores principales que determinan la forma de la red cristalina son las
cargas relativas de los iones y sus tamaños relativos. Existen algunas
estructuras que son adoptadas por varios compuestos, por ejemplo, la estructura
cristalina del cloruro de sodio también es adoptada por muchos haluros
alcalinos y óxidos binarios, tales como MgO.
Enlace Covalente
Lewis
expuso la teoría de que todos los elementos tienen tendencia a conseguir
configuración electrónica de gas noble (8 electrones en la última capa).
Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen
dicha configuración por captura de electrones; elementos situados a la
izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de
electrones. De esta forma la combinación de un metal con un no metal se hace
por enlace iónico; pero la combinación de no metales entre sí no puede tener
lugar mediante este proceso de transferencia de electrones; por lo que Lewis
supuso que debían compartirlos.
El químico estadounidense Lewis propuso la estructura de puntos para explicar el enlace covalente por ejemplo las moléculas de Cl2, Br2 y I2 son no metales de la familia 17, y todos poseen 7 electrones de su valencia. su estructura de Lewis se ilustra a continuación.
Cuando el cloro se combina con otro atomo de cloro con la misma estructura de Lewis resulta lo siguiente.
Los atomos de Bromo y Yodo se unen de la misma manera.
Así se forma el enlace. Cuando se comparte un par de electrones, se forma un Enlace Covalente, que se puede representar con una linea, como se indica enseguida.
Es
posible también la formación de enlaces múltiples, o sea, la compartición de
más de un par de electrones por una pareja de átomos. En otros casos, el par
compartido es aportado por sólo uno de los átomos, formándose entonces un
enlace que se llama coordinado o dativo. Se han encontrado compuestos
covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de
boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre
consigue hasta doce electrones. Esto hace que actualmente se piense que lo
característico del enlace covalente es la formación de pares electrónicos
compartidos, independientemente de su número.
Fuerzas intermoleculares
A
diferencia que sucede con los compuestos iónicos, en las sustancias covalentes
existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de
cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse
ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de
orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas
de inducción (ion o dipolo permanente producen en una molécula no polar una
separación de cargas por el fenómeno de inducción electrostática) y fuerzas de
dispersión (aparecen en tres moléculas no polares).
Propiedades de los
compuestos covalentes
Las
fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas,
pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya
que la agitación térmica domina, ya a temperaturas bajas, sobre las débiles
fuerzas de cohesión. La mayor parte de las sustancias covalentes, a temperatura
ambiente, son gases o líquidos de punto de ebullición bajo (por ejemplo el
agua). En cuanto a la solubilidad, puede decirse que, en general, las
sustancias covalentes son solubles en disolventes no polares y no lo son en
disolventes polares. Se conocen algunos sólidos covalentes prácticamente
infusibles e insolubles, que son excepción al comportamiento general descrito.
Un ejemplo de ellos es el diamante.
La
gran estabilidad de estas redes cristalinas se debe a que los átomos que las
forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red
es necesario romper estos enlaces, los cual consume enormes cantidades de
energía
Electrovalencia y covalencia
Teniendo
presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la
valencia de un elemento cualquiera a partir de su configuración electrónica.
La
electrovalencia, valencia en la formación de compuestos iónicos, es el número de
electrones que el átomo tiene que ganar o perder para conseguir la
configuración de los gases nobles.
La
covalencia, número de enlaces covalentes que puede formar un átomo, es el
número de electrones desapareados que tiene dicho átomo. Hay que tener presente
que un átomo puede desaparecer sus electrones al máximo siempre que para ello
no haya de pasar ningún electrón a un nivel energético superior.
ENLACE METÁLICO
Los
elementos metálicos sin combinar forman redes cristalinas con elevado índice de
coordinación. Hay tres tipos de red cristalina metálica: cúbica centrada en las
caras, con coordinación doce; cúbica centrada en el cuerpo, con coordinación
ocho, y hexagonal compacta, con coordinación doce. Sin embargo, el número de
electrones de valencia de cualquier átomo metálico es pequeño, en todo caso
inferior al número de átomos que rodean a un dado, por lo cual no es posible
suponer el establecimiento de tantos enlaces covalentes.
En
el enlace metálico, los átomos se transforman en iones y electrones, en lugar
de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos.
Intuitivamente, la red cristalina metálica puede considerarse formada por una
serie de átomos alrededor de los cuales los electrones sueltos forman una nube
que mantiene unido al conjunto.
¿Alguna vez has tenido un trozo de metal? puede ser hiero, cobre, plata, oro, etc. Cualquiera de ellos esta formado por millones de átomos de dicho elemento, pero ¿te has preguntado alguna vez como están unidos estos átomos?
Observemos en la siguiente figura que se encuentra abajo, que es un alambre de oro
En primer lugar notaras que tiene brillo y que es solido. Para ser alambre se requiere estirar el material, es decir, que sea dúctil. Si tomas un pedazo de este alambre, que también puede ser de Cobre, y lo golpeas con un martillo puedes obtener una lamina delgada, es decir el material es maleable.
Como sabes, para conducir la electricidad generalmente se usan cables hechos de metales. (como ejemplo tenemos el Cobre)
Ahora trataremos de entender por que un material metálico se comporta de esta manera.
Generalmente, el metal es la unión entre átomos del mismo elemento: Cobre, Oro, Plata; los cuales se agrupan de forma muy cercanas unos a otros y da como resultado que los electrones de valencia de cada átomo se repartan los átomos del material metálico; a este se le llama, enlace metálico Este enlace se ejemplifica con la siguiente figura donde el enlace metálico se visualiza como una nube de electrones que se mueve en todo el material metálico.
¿CUALES SON LOS ELEMENTOS QUÍMICOS IMPORTANTES PARA EL BUEN FUNCIONAMIENTO DE NUESTRO CUERPO?
Es sorprendente que solo cuatro
elementos químicos formen 99% de nuestro cuerpo, otros siete elementos
constituyen el otro 1%, y que otros 13 elementos que existen en cantidades muy
pequeñas sean tan indispensables para el buen funcionamiento de nuestro cuerpo.
Nuestro organismo así como el de todos los seres vivos está formado por células.
Estas
a su vez están formadas por diferentes organelos formados por proteínas,
lípidos, carbohidratos, ácidos nucleicos, etc. que no son mas que sustancias
químicas formadas por la integración de diversos elementos
químicos.
Además,
en los organelos y en la célula en general, se realizan diversas funciones
vitales mediante procesos denominados rutas metabólicas, estas consisten en
una serie indeterminada de reacciones químicas.
Los elementos quimicos son muy importantes para los seres vivos. Aproximadamente unos 22 elementos o mas se encuentran en estos en abundancia y cumplen cierta funcion.
Estos elementos se Clasifican en:
* Bioelementos Primarios: C.H.O.N.P. y S. Enconjunto representan un 96.2 % de los elementos que forman a los seres vivos o, especificamente, el cuerpo humano.
*
Bioelementos Secundarios: Na, K, Ca, Mg y Cl. Aunque se encuentran en
menor proporcion que los primarios, tambien son impresindibles para los seres
vivos. en un medio acuoso, se encuentran siempre ionizados.
*
Oligoelementos o Elementos Vestigiales: En este elementos se encuentran
divididos en dos grupos; Los Indispensables son; Mn, Fe, Co, Cu,
Zn, y Los Variables son; B, Al, V, Mo, I, y Si, Son
aquellos bioelementos que se encuentran en los seres vivos en un porcentaje
inferior al 0.1% Algunos, los indispensables, se hayan en todo ser viviente,
mientras que otros, variables solamente los necesitan algunos organismos; tales
como el caso del Hierro y el Zinc entre otros.
Oxígeno (O): (65%)
Todos
sabemos cuán importante es el agua para la vida y el 60% del peso del
cuerpo se constituye por agua. El oxígeno (O,8) ocupa el primer lugar de la
lista y compone el 65% del organismo.
Carbono (C): (18%)
El
carbono (C,6) es uno de los elementos más importantes para la vida. Mediante
los enlaces carbono, que pueden formarse y romperse con una mínima cantidad de
energía, se posibilita la química orgánica dinámica que se produce a nivel
celular.
Hidrógeno (H): (10%)
El
hidrógeno (H,1) es el elemento químico que más abunda en todo el universo. En
nuestro organismo sucede algo muy similar y junto al oxígeno en forma de agua
ocupa el tercer lugar de esta lista.
Nitrógeno (N): (3%)
Presente
en muchísimas moléculas orgánicas, el nitrógeno (N,7) constituye el 3% del
cuerpo humano. Se encuentra, por ejemplo, en los aminoácidos que forman las
proteínas y en los ácidos nucleicos de nuestro ADN.
Calcio (Ca): (1.5%)
De
los minerales que componen el organismo, el calcio (Ca,20) es el más abundante
y es vital para nuestro desarrollo. Se encuentra prácticamente a lo largo de
todo el cuerpo, en los huesos y por ejemplo en los dientes. Además, son muy
importantes en la regulación de proteínas.
Fósforo (P): (1%)
El
fósforo (P,15) también es muy importante para las estructuras óseas del cuerpo
en donde abunda. No obstante, igualmente predominan en las moléculas de ATP
proporcionándole energía a las células.
Potasio (K): (0.25%)
Aunque
ocupa apenas el 0.25% de nuestro organismo, el potasio (K,19) es vital para el
funcionamiento del mismo. Ayuda en la regulación de los latidos del corazón y a
la señalización eléctrica de los nervios.
Azufre (S): (0.25%)
El
azufre (S,16) es igual de esencial en la química de numerosos organismos. Se
encuentra en los aminoácidos y es fundamental para darle forma a las proteínas.
Sodio (Na): (0.15%)
Se
trata de otro electrolito vital en lo que refiere a la señalización eléctrica
de los nervios. El sodio (Na,11) también regula la cantidad de agua en el
cuerpo, siendo un elemento igual de esencial para la vida.
Cloro (Cl): (0.15%)
El
cloro (CI,17) normalmente se encuentra en el cuerpo humano a modo de ion
negativo, es decir como cloruro. Se trata de un electrolito importante para
mantener el equilibrio normal de líquidos en el organismo.
Magnesio (Mg): (0.05%)
Nuevamente,
se encuentra en la estructura ósea y de los músculos, siendo muy importante en
ambas. El magnesio (Mg,12), a su vez, es necesario en numerosas reacciones
metabólicas esenciales para la vida.
Hierro (Fe): (0.006%)
Aunque
el hierro (Fe,26) ocupa el último lugar de la lista, no deja de ser primordial.
Es fundamental en el metabolismo de casi todos los organismos vivos. Se
encuentra en la hemoglobina, es el portador de oxígeno en las células rojas de
la sangre.
Cobalto (Co):
Lo
podemos encontrar en algunos vegetales como el rábano, las cebollas, la
coliflor y las setas; también lo encontramos en carnes y crustáceos. Sus
propiedades previenen la osteoartritis y es un excelente anti-anémico. Componente
central de la vitamina B12.
Cobre (Cu):
Estimula
el sistema inmunitario. Podemos obtenerlo en los vegetales verdes, el pescado,
los guisantes, las lentejas, el hígado, los moluscos y los crustáceos, vísceras,
frijoles, cereales, frutos y carne de pollo. Forma parte de los tejidos
corporales como el hígado, cerebro, riñones y corazón; y su función es prevenir
infecciones de las vías respiratorias, reumatismos y aceleración de la síntesis
de la queratina.
Flúor (F):
Lo
encontramos en el agua y el té. Una de sus principales funciones es prevenir la
caries dental.
Manganeso (Mn):
Este
oligoelemento lo podemos localizar en cereales, almendras, legumbres, frutas
secas, pescados y soya Es parte importante en la constitución de ciertas
enzimas, su deficiencia produce pérdida de peso, dermatitis y náuseas; se cree
que participa en funciones sexuales y reproductoras. En el organismo se
encuentra principalmente en el hígado, huesos, páncreas e hipófisis.
Selenio (Se):
Este
elemento se ubica en los cereales completos, la levadura de cerveza, ajo,
cebolla, germen de trigo y carnes. La función que desempeña en el organismo es
la de neutralizar los radicales libres (envejecimiento), retrasa los procesos
de la miopía y preserva la tonicidad de la piel.
Yodo (I):
Las
principales fuentes donde se localiza este oligoelemento es en los productos de
mar como los mariscos. Este elemento es indispensable al ser constituyente de
las hormonas tiroideas.
Zinc (Zn):
Lo
encontramos en las carnes rojas, pescado, pollo, productos lácteos, frijoles,
granos y nueces. Su función dentro del organismo es la de acelerar la
cicatrización de las heridas, favorecer en el crecimiento del feto en mujeres
embarazadas, participar en la formación del colágeno y de la elastina de la
dermis, favorecer el tránsito intestinal y participar en el buen funcionamiento
de la próstata y de los ovarios.
Boro (B):
Mantenimiento
de la estructura de la pared celular en los vegetales.
Cromo (Cr):
Potencia
la acción de la insulina y favorece la entrada de glucosa a las células. Su
contenido en los órganos del cuerpo decrece con la edad. Los berros, las algas,
las carnes magras, las hortalizas, las aceitunas y los cítricos (naranjas,
limones, toronjas, etc.), el hígado y los riñones son excelentes proveedores de
cromo.
Molibdeno (Mo):
Se
encuentra en una cantidad importante en el agua de mar en forma de molibdatos
(MoO42-), y los seres vivos pueden absorberlo fácilmente de esta forma. Tiene
la función de transferir átomos de oxígeno al agua.
Níquel. (Ni):
Es
necesario para el buen funcionamiento del páncreas. Fuentes: legumbres,
cereales integrales, espinacas y perejil.
Silicio (Si):
Es
indispensable para la asimilación del calcio, la formación de nuevas células y
en la nutrición de los tejidos. Fuentes: agua potable y alimentos vegetales en
general. A pesar de que puede encontrarse en otros, estos son los más
importantes:
Origen vegetal: Aguacate, Alfalfa, Arroz integral,
Caña de azúcar, Cebolla. Cola de caballo, Diente de león, Eneldo, Espinacas, Fresa,
Harina de avena integral, Judías verdes, Lechuga, Mastuerzo,
Pasas, Pepino, Perejil, Plátanos, Puerros, Remolacha,
Salvado de trigo, Tomates, Zanahoria, La pectina de los cítricos y
los alginatos.
Vanadio (V):
El
vanadio es un elemento esencial en algunos organismos. En humanos no está
demostrada su esencialidad, aunque existen compuestos de vanadio que imitan y
potencian la actividad de la insulina.
En
las siguiente Tabla te damos a conocer las características Complementarias
de los elementos químicos y su clasificación.
Elemento Qímico
|
Símbolo
|
% presente
|
Donde se encuentran y sus funciones:
|
Oxígeno
|
O
|
65%
|
Presente en el agua y casi todas las moléculas orgánicas. Necesario para la respiración
|
Carbono
|
C
|
18.5%
|
Presente en todas las moléculas orgánicas
|
Hidrógeno
|
H
|
9.5%
|
Presente en el agua, nutrientes, casi todas las moléculas orgánicas; contribuye a la acidez cuando está cargado positivamente
|
Nitrógeno
|
N
|
3.2%
|
Presente en las proteínas y ácidos nucleicos
|
Calcio
|
Ca
|
1.5%
|
Constituyente de los huesos y dientes, se encuentra en productos lácteos; necesario para los procesos de contracción muscular, coagulación sanguínea, movimientos intracelulares, liberación de neurotransmisores, etc.
|
Fósforo
|
P
|
1.0%
|
Constituyente de huesos y dientes. Presente en una gran cantidad de alimentos, siendo los más destacados el hígado de cerdo, el bacalao seco, el atún en aceite, etc.
|
Potasio
|
K
|
0.4%
|
Catión más abundante en el interior de las células; necesario para la conducción nerviosa y la contracción muscular, se encuentra en vegetales de hoja verde, fruta en general y patatas.
|
Azufre
|
S
|
0.3%
|
Forma parte de muchas proteínas, especialmente las contráctiles
|
Sodio
|
Na
|
0.2%
|
Catión más abundante en el medio extracelular; necesario para la conducción nerviosa y la contracción muscular, Presente en casi todos los alimentos como un ingrediente natural
|
Cloro
|
Cl
|
0.2%
|
Anión más frecuente; necesario para mantener el balance de agua en la sangre y fluído intersticial
|
Magnesio
|
Mg
|
0.1%
|
Necesario para que muchas enzimas funcionen correctamente, se encuentra en frutos secos, cacao, soya, semillas integrales, almendras, nueces, cacahuates, mariscos, verduras
|
Iodo
|
I
|
0.1%
|
Vital para la producción de hormonas de la glándula tiroides
|
Hierro
|
Fe
|
0.1%
|
Componente esencial de la hemoglobina y de algunas enzimas necesarias para la producción de ATP
|
Aluminio
Boro Cromo Cobalto Cobre Estaño Flúor Manganeso Molibdeno Selenio Silicio Vanadio Zinc |
Al
B Cr Co Cu Sn F Mn Mo Se Si Va Zn |
_
|
Estos elementos se denominan oligoelementos por estar presentes en concentraciones mínimas
|
¿Cuál es la diferencia entre macronutrientes y micronutrientes?
Los macronutrientes son los que aportan la mayor parte de la energía para el metabolismo del organismo, ayudan al crecimiento y mantenimiento del cuerpo. Y los micronutrientes son los que se necesitan en pequeñas cantidades para el buen funcionamiento del organismo.
¿Cuáles don los bioelementos que debemos consumir en nuestra dieta? Todos,ningún alimento es completo. Una dieta equilibrada debe tener a diario elementos de los grupos principales de alimentos que se indican.
-¿Qué alimentos los contienen?
Leche y productos lácteos: leche,
yogur, queso, petit suisses, natillas o similares: aportan calcio, proteínas y
lípidos. ¡Incluye un producto lácteo en cada comida!
Carnes, pescados, embutidos y huevos:
son muy ricos en proteínas, indispensables para la vida de las células y para
la estructura de nuestra masa muscular. Aportan además hierro, vitamina B y
lípidos.
Debes consumir 200 a 250 g. al día, es decir, una porción de carne o pescado o huevos en cada comida principal (un bistec de lOO g = un muslo de pollo = 130g de pescado = 2 huevos).
Fruta y verduras: son ricos en
minerales, vitaminas (C) y azúcares. También aportan fibra, necesaria para el
buen funcionamiento del intestino. Come tantas como desees.
Pasta, patatas, cereales (arroz o pan)
y legumbres: son una buena fuente de energía y fibra. Combínalas de forma que
comas varias raciones cada día.
El agua es un elemento
indispensable para nuestro equilibrio y se debe beber a diario, se puede hacer
en forma de batidos, zumos, yogures, etc.
































.jpg)
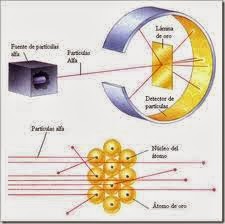

.jpg)



















.jpg)


















.jpg)







.jpg)
.jpg)
.jpg)
.jpg)


































